Выращивание и пересадка индивидуально васкуляризованного костного трансплантата у мужчины
Введение
После того, как исследовательская группа Vacanti в 1997 представила мышь с человеческим ухом, выращенным на ее спине, возрос мировой интерес к тканевой инженерии и подготовительным методикам. Продемонстрированная технология в конечном итоге может позволить производить суррогатные органы или части тела внутри человеческого тела. 2, 3 Успех сделает ненужным поиск донорских органов и устранит хорошо известные трудности, связанные с аллогенной трансплантацией органов.
Наше исследование было сфокусировано на новых подходах в поиске заместителей костных дефектов, особенно для значительных по размеру дефектов нижней челюсти. 4-7 На сегодняшний день, нижняя челюсть с большим неравномерным дефектом, более чем 5 см, например после ампутационного хирургического лечения опухоли, может быть восстановлена с использованием аутологичной васкуляризованной малоберцовой кости, лопатки, гребешка подвздошной кости или трансплантатом ребра. Эта техника костной трансплантации клинически одобрена, и успешно применяется в хирургических центрах лечения рака во всем мире. Однако существенным недостатком этой методики является то, что процесс забора вышеперечисленных костных трансплантатов всегда создает другой дефект скелета, который сам по себе представляет серьезное заболевание. В 2001 мы продемонстрировали на модели мини-свиньи способ подготовки трансплантата, который позволяет обойти 4-6 необходимость создания вторичного дефекта скелета из-за забора костного трансплантата.
ВМР7 – это остеоиндуктивный фактор (bone morphogenetic protein – костный морфогенетический белок – прим. переводчика), который инициирует превращение недифференцированных стволовых клеток-предшественников в остеопрогенитические клетки, продуцирующие зрелую кость. 5-9 После одобрения Администрацией Лечебных Товаров (Министерства Здравоохранения Австралии)в 2001 использования на людях рекомбинантного человеческого ВМР7 9-10, появилась возможность создавать костные трансплантаты для восстановления после хирургического лечения злокачественной опухоли.
Мужчина 56 лет, который был подвергнут 8 лет назад ампутационному хирургическому лечению злокачественной опухоли в виде субтотального удаления нижней челюсти, обратился к нам с просьбой восстановить его нижнюю челюсть, резецированную от парамедиальной левой области до ретромолярной правой области. После первоначального хирургического вмешательства этот значительный по размеру дефект, более чем 7 см, был соединен титановой пластинкой (рис.1). Затем в тоже время область головы и шеи пациента была подвергнута радиационному лечению (общая доза 66 Gy). Т.к. пациент принимал антикоагулянт варфарин вследствие замены аортального клапана, мы должны были свести костные дефекты до минимума, чтобы избежать серьезного постоперационного кровотечения. Чтобы предотвратить образование донорского костного дефекта, пациент был отобран для костно-мышечного способа подготовки трансплантата. Целью было вырастить внутри широчайшей мышцы спины субтотальный трансплантат нижней челюсти с полной костной целостностью и адекватной сосудистой ножкой, что позволит в последующем совершить пересадку жизнеспособного трансплантата в дефект. Кроме того, мы стремились к тому, чтобы создать трансплантат индивидуальной формы, идеально подходящий к дефекту, что увеличивает шансы достижения полноценной постоперационной функции и удовлетворительного эстетического результата.
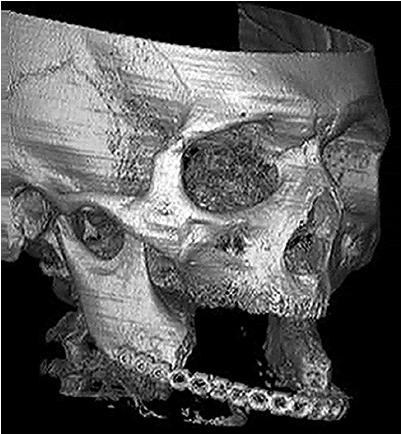
Рис. 1. Трехмерная компьютерная томография обширного дефекта
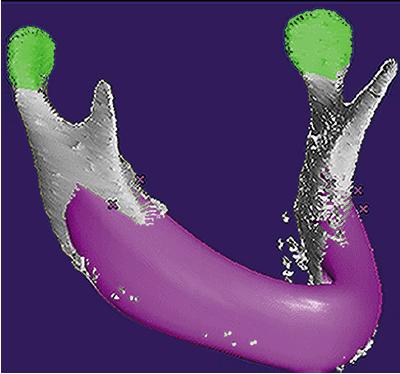
Рис. 1. компьютерное планирование идеального нижнечелюстного трансплантата
Методы
Было получено этическое одобрение от университета Kiel, Германия. Пациент дал письменное согласие. Мы сделали трехмерную компьютерную томографию (СТ) головы пациента и смоделировали идеальную виртуальную замену отсутствующей части нижней челюсти при помощи системы автоматизированного проектирования (CAD, рис. 1) . Данные были переданы на трехосевой фрезерный станок с компьютерным управлением, и была создана тефлоновая модель, точно соответствующая виртуальному участку нижней челюсти.
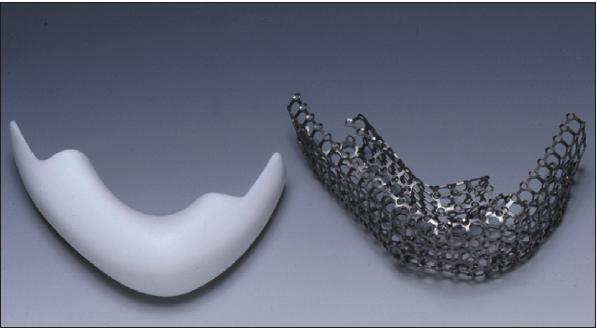
Рис. 2. Тефлоновая модель нижней челюсти (слева) и титановый ячеистый каркас (справа).
Затем по модели был сформирован титановый ячеистый каркас (MARTIN, Micromesh, Tuttlingen, Germany). Впоследствии тефлоновая модель была удалена, и оставшаяся титановая ячеистая клетка была заполнена десятью костными минеральными блоками, в качестве носителей (BioOss-Blocks; Geistlich Biomaterials, Wolhusen, Switzerland). Блоки были покрыты 7 мг рекомбинантного человеческого BMP7, внедренного в 1 г бычьего коллагена 1 типа (OP-1 implant, Stryker Biotech, Hopkinton, USA; рис. 3). В заключение, было получено 20 мл пунктата костного мозга из гребня подвздошной кости справа, чтобы обеспечить наличие недифференцированных клеток предшественников, как мишень для рекомбинантного человеческого BMP7. Мы не анализировали пунктат методом проточной цитометрии для того, чтобы убедиться в наличие стволовых клеток в нем. Костный мозг был смешан с 5 г естественного костного минерала бычьего происхождения (размер частиц 0·5-1·0 mm; BioOss-Spongiosa гранулы; Geistlich Biomaterials), и эта смесь была использована для заполнения промежутков между блоками внутри клетки. Затем титановый ячеистый каркас был имплантирован в сумку правой широчайшей мышцы спины (m. latissimus dorsi) пациента (рис. 3, 4) под общим наркозом. У пациента развилась постоперационная гематома, которая была просто дренирована на второй день после операции. Мы назначили антибиотики с целью профилактики: 1,5 г ampicillin/sulbactam 3 раза в день в течение 14 дней. Признаков инфекции не было обнаружено. Пациент не жаловался на боль или расстройство сна, и высказывал только небольшое беспокойство о диапазоне движений своей правой руки.
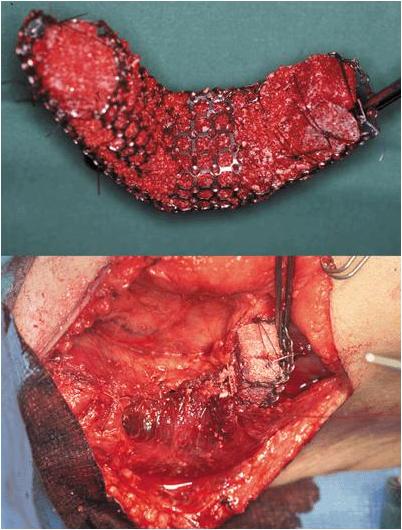
Рис. 3. Титановая ячеистая клетка, заполненная костными минеральными блоками, инфильтрированными рекомбинантным человеческим BMP 7 и смесью костного мозга (вверху), и имплантация в правую широчайшую мышцу спины (внизу).
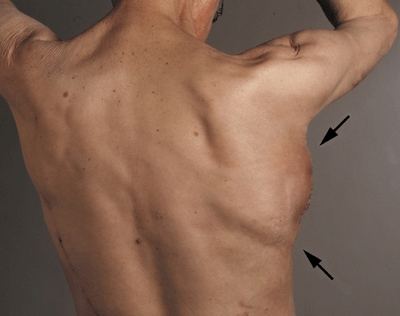
Рис. 4. Вид со спины трансплантата нижней челюсти через 3 недели после имплантации. Стрелки показывают области имплантации внутри широчайшей мышцы спины (m. latissimus dorsi).
Результаты
Через четыре недели после операции мы сделали сцинтиграфию скелета с интарвенозным введением 600 MBq (Bq - беккерель - единица активности нуклида в радиоактивном источнике – прим. переводчика) меченых атомов technetium-99m-oxydronate. Внутри имплантата была обнаружена вновь формирующаяся кость с витальными остеобластами. Это подтверждало повышенное количество меченых атомов, что является первым признаком успешного роста кости (рис. 5). Кроме того, СТ грудной клетки выявило рентгенологические признаки образования кости вокруг места имплантации (рис. 6).
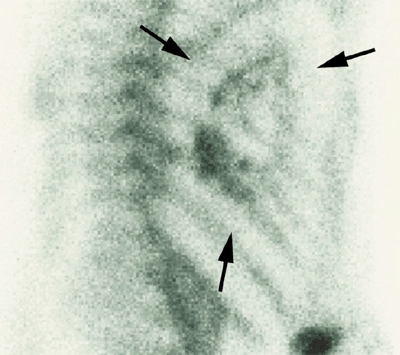
Рис. 5. Сцинтиграфия скелета. Стрелки показывают на U-образной формы трансплантат нижней челюсти (сцинтиграфия через 3 часа после инъекции меченых атомов).
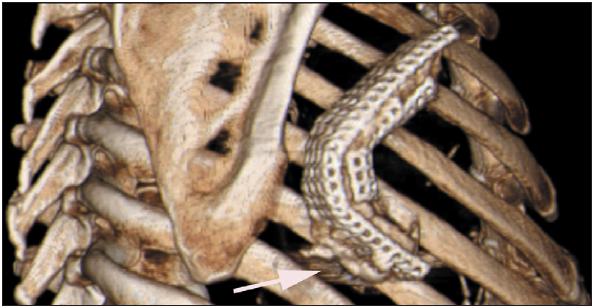
Рис. 6. Трехмерная компьютерная томография имплантата. Стрелкой показано образование новой кости, прорастающей через титановый каркас.
Через 7 недель после первой операции, пациента снова подвергли общему наркозу для пересадки трансплантата нижней челюсти. Трансплантат был забран вместе с прилегающей частью широчайшей мышцы спины, содержащей торакодорзальную (thoracodorsal) артерию и вену, которая снабжала кровью весь трансплантат. Затем этот костно-мышечный трансплантат на ножке был установлен в область дефекта через экстраоральный доступ. Небольшое количество излишне выросшей кости на краях трансплантата соскоблили кюреткой, чтобы легко посадить его на место дефекта. Никакой дополнительной коррекции формы или очертаний трансплантата не потребовалось.
После того, как старая титановая восстановительная пластинка (рис.1) была удалена, трансплантат зафиксировали на исходных культях нижней челюсти титановыми микро винтами для остеосинтеза, возвращая линии нижней челюсти примерно такой же контур, как до мандибулоэктомии.
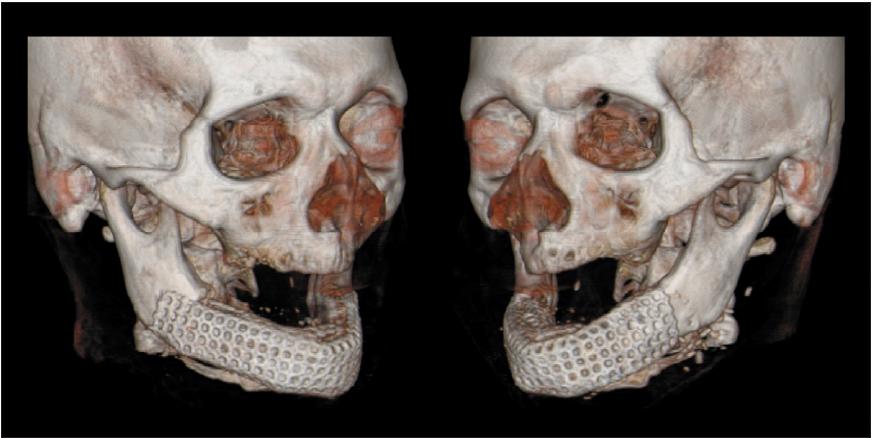
Рис. 7. Трехмерная компьютерная томография нижней челюсти после пересадки трансплантата.
Сосудистая ножка затем была анастомозирована с наружной сонной артерией (external carotid artery) и цефалической веной (cephalic vein) при помощи микрохирургической техники. Цефалическая вена была взята с плеча и перенесена в область шеи, т.к. несколько местных, подходящих вен были непригодны, из-за предшествующего радикального иссечения и облучения шеи. Мы не смогли полностью закрыть рану в субмандибулярной области, потому что у пациента неэластичная, облученная кожа. Профилактическое прикрытие антибиотиками было снова обеспечено 1,5 г ampicillin/ sulbactam 3 раза в день. Через 12 дней после операции эта маленькая область закрылась самопроизвольно путем роста грануляционной ткани. Затем этот участок был прикрыт трансплантатом кожи полноценной толщины. За исключением небольшой, регулируемой области некроза края раны (ранее облученной кожи), заживление происходило спокойно. Кровоснабжение трансплантата было обеспечено успешно. Повторная трехмерная томография показала, что обе культи нижней челюсти находятся в правильном положении относительно трансплантата (рис. 8). Мы выполнили вторую сцинтиграфию скелета на 11 день после операции с введением 600 MBq Tc99m-oxydronate меченых атомов, и увидели продолжающийся рост кости и минерализацию внутри трансплантата нижней челюсти, указывающие на ненарушенное кровоснабжение и сохранение жизнеспособности, внедренных клеток костного мозга (рис. 8).
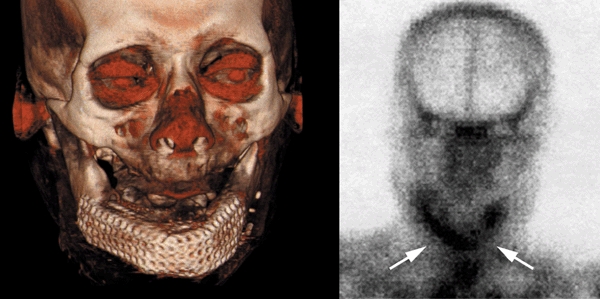
Рис. 8. Трехмерная компьютерная томография (слева) после пересадки костного трансплантата с повышением четкости мягких тканей (красное) и повторная сцинтиграфия скелета (справа) с увеличенным количеством меченых атомов в области трансплантата, доказывающим продолжающийся рост и минерализацию кости (стрелки).
Обсуждение
Для того чтобы максимизировать потенциал успешного роста кости в этом исследовании, мы применили и рекомбинантный человеческий ВМР 7 и «родной» пунктат костного мозга. Несмотря на то, что такой метод оказался несомненно успешным, мы не можем сделать вывод: связана ли регенрация костной ткани с клетками костного мозга или с ВМР 7 – вероятно необходима комбинация обоих. В предшествующем исследовании нашего факультета на модели мини-свиньи был сделан вывод о том, что рекомбинантный человеческий ВМР 7 является белком, потенцирующим рост кости, когда используется в широчайшей мышце спины даже без пунктата аутологичного костного мозга. 4-6, 11 Следовательно, мы можем предположить, что образование кости в представленном клиническом случае было результатом рекрутирования рекомбинантным человеческим ВМР 7 и местных недифференцированных клеток-предшественников и недифференцированных клеток-предшественников из пунктата костного мозга.
При дальнейшей минерализации вновь выросшей кости мы надеемся удалить наружный титановый ячеистый каркас через 1 год после трансплантации. Если удаление каркаса будет возможным, то восстановленная нижняя челюсть станет объектом нормальной функциональной нагрузки, и впоследствии будет видоизменяться. 12 Таким образом, результатом этого процесса может стать формирование гистологической структуры, соответствующей структуре нормальной нижней челюсти. Будет или нет возможным удаление титанового каркаса, установка имплантатов, установка имплантатов зубов станет шагом к дальнейшему увеличению жевательной функции. По этическим соображениям мы не смогли сделать забор ткани из трансплантата нижней челюсти для гистологического анализа. Если в будущем будет предпринята попытка установить имплантаты зубов, мы сможем воспользоваться благоприятной возможностью, чтобы получить небольшие образцы бывшего трансплантата нижней челюсти для выполнения такого анализа.
Избежать больших костных дефектов при трансплантации кости – это основная цель. Несмотря на то, что наша технология все еще включает в себя создание дефекта мягких тканей донорского участка, она может позволить Вам избежать создания полноценного костного дефекта у пациентов. Эта возможность может значительно уменьшить заболеваемость и травматичность, связанную с костной трансплантацией, и может даже улучшить эстетический результат таких операций. Если использовать традиционную технику для восстановления нижней челюсти при дефектах таких размеров, как в представленном случае, то рекомендована трансплантация микроваскуляризованной малоберцовой кости. Такой подход приведет к созданию значительного дефекта кости и мягких тканей нижней конечности – заболевание, связанное с этим дефектом будет существенным.
Насколько нам известно, этот клинический случай доказывает, что возможно выращивание гетеротопической кости для формирования трансплантата нижней челюсти внутри широчайшей мышцы спины у человека с применением подготовительной методики. Описанная подготовительная методика и последующее восстановление нижней челюсти свободным трансплантатом позволяют уменьшить тяжесть операции и получить более лучший объемный результат, чем при использовании традиционных восстановительных технологий. Мы предполагаем, что наши результаты представляют доказательство этого принципа. Множество существенных вопросов остается без ответа. Существующий ход вещей, достигнутый в результате у представленного пациента, стимулирует нашу группу к расширению этого исследования на других пациентах. Для того чтобы получить непоколебимые выводы, нам необходим длительный период проверки. Мы надеемся представить позднее долгосрочный результат у этого пациента и у будущих таких же пациентов.
Перевод: Уханов М.М.
Killere 27.01.2009





11 комментариев
Ирина (0)
21.06.2011 19:10
А меня проблема коснулась вплотную. У моего сына стоит эндопротез и организм его отторгает, вот бы нам такую методику в Украине применить! Скажите источник, где это делали?
ролролролорлролро (-3)
06.04.2010 17:24
орплрплддпрдапроапроавшповдолапшщукего8г684г6е9омагшщфротц3 олиййгкрг324кцоуагшер5гшщнтшщпргр5гп4шгр5
FunArt (47)
31.07.2009 18:24
Ученые, даешь клонирование !
Killere (28)
28.01.2009 07:21
Могу сказать что выращивание органов тоже уже не фонтастика, правда конечно не все органы покачто получаеться репродуктировать. Через некоторое время выложу новую ветку на тему репродуктированиая органов человека.
domsexa (0)
28.01.2009 05:22
Жестоко конечно !
мариша (52)
27.01.2009 23:38
Потрясена, правда! Хотя я и застревала на медицинских терминах, но общую идею уловила. Но, опять же, это вырашивание органа внутри самого пациента, а не было ли попыток вырастить орган целиком вовне? Хотя и такая идея просто чудо какое то!
Taker (2)
27.01.2009 23:17
И все-таки, не удачно я добрался до третьего рисунка именно в тот момент, когда яблоко хрумкал…
Piglette (136)
27.01.2009 16:10
прямо как будто доктора хауса посмотрела: интересно, но ничего не понятно:)
Killere (28)
27.01.2009 13:55
Но притом всем что мужчина не сможет ощутить все уловольствия он может полноценно использовать его в сексе, конечно половой орган постоянно находиться в возбужденном состояние. Дальнейшие иследования пациента мне не известны.
Killere (28)
27.01.2009 13:50
Прости! К сожелению небыло времени перебирать данную тему, я на работе и поэтому на скорую руку выложил данную тему. В кратких словах получаеться то что врачи используют костный мозг для регенирации тканей челвоека, по той причине что в нем содержиться большая генетическая информация и то что он быстрее регенерирует. Так же читал на данную тему что мужчине у которого были проблемы с половым органом выростили его половой орган у него на спине, конечно у него не будет тех полноценныйх ощущений.
Taker (2)
27.01.2009 12:48
Спасибо. Я все прочитал и честно пытался вникнуть, но понял только обобщенно - все-таки, слишком много непонятных для меня медицинских терминов. Хотя сама идея замечательная и удивительная.